bold信号中噪声
作者:synge (noreply@blogger.com)
目前最流行的脑成像技术是基于血氧水平依赖 (bold)信号的功能磁共振成像 (fmri)。bold由ogawa于上世纪90年代提出,由于其安全无放射性,迅速成为了研究人类正常大脑功能的主流方法。bold方法最大的问题是它并不是直接测量神经活动,而是间接通过测量局部血氧水平来反映神经活动。简单来说,一个区域的神经元活动会消耗能量及血氧,导致局部血氧水平的短暂降低。随后大脑供血机制会使这个区域的血流量和血容积增加。随着新鲜血液的到来,局部的血氧水平反而会超过神经活动之前的水平,这就是血液的过补偿。而bold信号实际上测量的就是血氧的相对水平。因此,再从神经活动到bold信号的复杂链条中,氧代谢、血流/血容积的变化都会对观测到的fmri“激活”产生影响。
最大的影响其实来自大血管。通常希望fmri激活的结果反映的是灰质内局部毛细血管的bold变化,但显然大血管的血流量更大,bold效应也更强。往往很小的激活或者噪声都会被大血管放大,同时统计得到的激活区域也会向大血管偏移。这些都是做fmri实验不想看到的。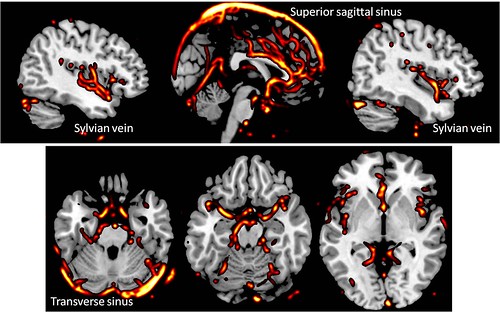
血管图像来自 brainweb
大血管的分布如何?上面这幅图也许会让人印象深刻,因为很多富含血管的区域也是脑成像研究的热门区域,比如前扣带回、脑岛和小脑。几年前annals of improbable research有一篇文章发现,报告扣带回激活的文章已经超过报告运动皮层的文章,而且与扣带回相关的认知功能也越来越无所不包。另外一个区域脑岛也在慢慢成为社会认知神经科学研究的热门区域。但这些区域都易受大血管的影响,使得激活结果值得怀疑。
不仅受大血管影响,大脑灰质不同区域的血氧响应强度也不相同。有一些区域的血氧响应很弱,这使得fmri的激活效果也变差,比如前颞叶、海马等区域。而血氧响应的影响主要是在进行被试间比较时。比如用fmri对比老年人和青年人在完成某一认知活动的激活差异。得到的差异可能是由神经活动的差异造成,也可能仅仅是由于老年人的血氧响应功能减弱而造成的。因此在做fmri实验,特别是进行组间比较时,对fmri激活图像的校正就变得十分必要。
前面说过,bold信号实际上来源于神经活动造成耗氧后的血氧补偿。那如果不改变神经活动,只让被试吸入二氧化碳,同样可以模拟大脑局部区域缺氧后的血氧补偿响应。通过测量吸入二氧化碳后bold信号的变化,就可以估计血氧响应的分布。在实际操作中更简单的方法是让被试憋气 (breath holding),也可以近似得到血氧响应的强弱分布图。而在一些较新的研究中,resting-state的低频振幅 (alff)也被用来近似得到血氧响应分布。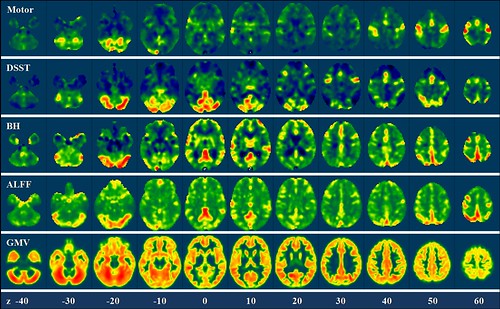
figure 2, in di et al., 2012
上图的前两行显示的是一个被试在完成手动任务和认知任务时全脑的激活分布,下面三行显示的是breath holding、alff和灰质体积的全脑分布。可以看到任务激活的很多区域与血氧响应高的区域重合,比如小脑后部和脑中线的一些区域。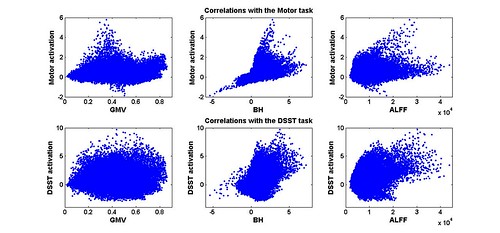
figure 3, in di et al., 2012
上图是这个被试全脑所有voxel中任务激活强度与各个生理信号的相关散点图,从中可以明显的看到血氧响应对激活的影响。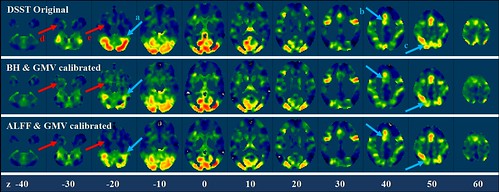
figure 8, in di et al., 2012
既然与任务完全无关的血氧响应信号对激活结果的影响如此明显,那么最简单的想法就是把这部分效应去除掉。在di et al., (2012)这篇研究里,使用了简单的线性回归的方法去除血氧响应和脑结构的影响。从上图可以看到,当去除血氧响应和灰质体积的信息后,很多易受血氧响应影响的脑区的信号都相应的增强或被抑制。平均来说,激活分布的10%左右的变异会被回归模型去除。
希望这种方法可以帮助更好的解释fmri实验中的激活结果。特别是在精神疾病的研究中,可以帮助区分脑结构变化、脑生理病变以及脑功能的差异。希望这个方法可以得到更多的应用。
biswal, b., kannurpatti, s., & rypma, b. (2007). hemodynamic scaling of fmri-bold signal: validation of low-frequency spectral amplitude as a scalability factor magnetic resonance imaging, 25 (10), 1358-1369 doi: 10.1016/j.mri.2007.03.022
xin di, sridhar s. kannurpatti, bart rypma, & bharat b. biswal (2012). calibrating bold fmri activations with neurovascular and anatomical constraints cereb. cortex doi: 10.1093/cercor/bhs001
bold信号中噪声-下载亚博
上一篇:科学家或将可以操纵记忆
相关推荐
婴儿大脑成为人工智能研究模型
婴儿大脑成为人工智能研究模型【techweb报道】3月14日消息,据国外媒体报道,科学家正在仿造婴儿大脑为人工智能建模。为何选择婴儿这种初级结构的大脑结构作为目标呢?也许当考虑到其极具可塑性的大脑灰质,答案也就不言而喻了。人工智
心理学
2020-10-23
